
 |
| | ||
| 31P-NMR | Energetik und Funktion | |
| Ischämie | ||
| In vivo CSI | ||
| Publikationen | ||
|
Erfassung der Energieträger mittels 31P-NMR-Spektroskopie |
||||
|
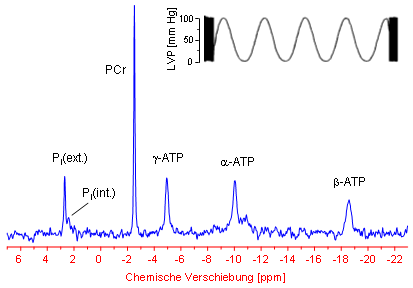
Damit das Herz regelmäßig schlagen kann, muß sein Energiehaushalt zuverlässig reguliert sein. Der wichtigste Energieträger im Körper ist das ATP, dessen chemische Strukur nebenstehend abgebildet ist. Dieses Molekül läßt sich mittels 31P-NMR-Spektroskopie ausgezeichnet detektieren – jedes der drei Phosphoratome liefert ein Signal, wie in der rechten Abbildung zu erkennen ist. | 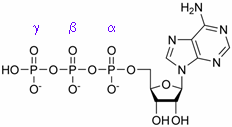
|
||
| Zusätzlich lassen sich im Spektrum des isoliert perfundierten Mäuseherzens noch Signale für das Phosphocreatin (PCr) sowie für das intra- und extrazelluläre anorganische Phosphat (markiert mit Pi(int.) bzw. Pi(ext.)) zuordnen. Speziell die Lage der letzteren Signale im Spektrum (die chemische Verschiebung) ist extrem stark vom pH-Wert der Umgebung abhängig, was genutzt werden kann, um sowohl den extrazellulären als auch den cytosolischen pH (pHe bzw. pHi) zu berechnen. | ||||
|
Lange Zeit glaubte man, daß nur die Höhe der ATP-Konzentration entscheidend für den Antrieb der energieverbrauchenden zellulären Prozesse sei. Mittlerweile ist jedoch gesichert, daß nicht alleine die ATP-Menge, sondern insbesondere das Verhältnis von ATP zu seinen Abbauprodukten ADP und Pi maßgebend für die aus der ATP-Hydrolyse (ATP ↔ ADP + Pi) gewonnene Energie ist. Die intrazelluläre ADP-Konzentration läßt sich aus dem 31P-NMR-Spektrum des Herzens über das Creatinkinase-Gleichgewicht (PCr + ADP ↔ ATP + Cr) ermitteln. Sie ist unter normalen Bedingungen etwa zwei Größenordnungen niedriger als der ATP-Gehalt (~30 µM ADP gegenüber ~6 mM ATP). Somit ist mit Hilfe der 31P-NMR-Spektroskopie die kontinuierliche und nichtinvasive Messung alle Größen, die zur Beurteilung der dem Herzen zur Verfügung stehenden Energie (ΔGATP) notwendig sind, möglich (→ mehr Details).
Über einen in den linken Ventrikel eingeführten und an einen Druckaufnehmer gekoppelten Ballon läßt sich parallel zur Energetik die Herzfunktion erfassen. Im oberen Teil des 31P-NMR-Spektrums ist exemplarisch eine damit aufgenommene Druckkurve abgebildet. Der gespreizte Bereich zeigt deutlich die regelmäßen Druckveränderungen während der Herzaktion. Die Minima der Kurve spiegeln den enddiastolischen und die Maxima den endsystolischen Druck wieder – aus deren Differenz berechnet sich der entwickelte Druck des Herzens. Des weiteren ergibt sich aus dem Abstand der Minima bzw. Maxima die Herzfrequenz, die bei der Maus mit ~600 Schlägen pro Minute etwa zehnmal so hoch ist wie beim Menschen. |
||||
| Nach oben |
Ischämie und Reperfusion |
|
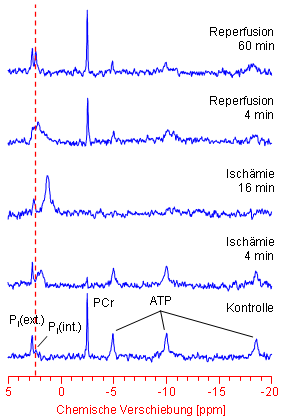
Die 31P-NMR-Spektroskopie eignet sich gut zur Untersuchung von Veränderungen des myokardialen Energiestoffwechsels bei Unterbrechung der Herzversorgung durch plötzlichen Verschluß der Herzgefäße, wie zum Beispiel bei einem Herzinfarkt. Dieses für den Menschen extrem gefährliche Ereignis kann man am isolierten Herzen durch Stoppen der Pufferzufuhr nachstellen. Die Phase ohne Versorgung bezeichnet man dabei als Ischämie, die nach Wiederherstellung der Versorgung als Reperfusion. |
|
||
|
Wie aus der linken Abbildung klar zu erkennen ist, führt die Unterbrechung der Herzversorgung unmittelbar zu einem Abfall des PCr- und einem Anstieg des Pi(int.)-Gehalts. Gleichzeitig erkennt man anhand der gestrichelten roten Linie eine Hochfeld-Verschiebung des Pi(int.)-Signals, die die Azidifizierung des unterversorgten Muskelgewebes widerspiegelt. Demgegenüber tritt selbst bei vollständiger Unterbrechung des koronaren Flusses ein kompletter ATP-Verlust erst nach ~15 Minuten ein.
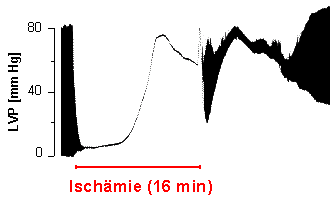
Parallel zum Verlust der Energieträger erfolgt ein Einbruch der Druckentwicklung und damit der Pumpfunktion des Herzens (rechte Abbildung). Nach kurzer Zeit kommt es zum völligen Erliegen der kontraktilen Funktion und etwas später zur Ausbildung der sogenannten Kontraktur (Druckanstieg während Ischämie), die auf die Überflutung des Cytosols mit Ca2+-Ionen zurückgeführt wird. Diese wiederum wird durch Zusammenbruch der membranären Ionengradienten bzw. Versagen ATP-getriebener Ionenpumpen aufgrund des gestörten Energiestatus bedingt. |
||||
|
Wird die Versorgung des Herzens wiederhergestellt, so erholt sich der PCr-Gehalt bereits nach wenigen Minuten. Des öfteren beobachtet man auch ein "Überschießen" des PCr über den Basalwert (PCr-Overshoot) zu Beginn der Reperfusion. Demgegenüber erreicht das ATP durch Purinverlust während der Ischämie bzw. in der initialen Reperfusionsphase in der Regel nicht seinen Ausgangswert. Nach der Normalisierung des pHi stabilisieren sich dann im weiteren Verlauf auch mehr und mehr die kontraktilen Parameter.
Inwieweit die ursprüngliche Herzfunktion wiederhergestellt werden kann, hängt von der Dauer der Ischämie und der angewandten "Therapie" (in Form zusätzlich infundierter Medikamente und/oder des verwendeten transgenen Modells) ab. So konnten wir zum Beispiel zeigen, daß sich Herzen ohne endotheliale Stickstoffmonoxid-Synthase (eNOS-Knockout-Tiere) besser von einer Ischämie erholen als die entsprechenden Kontrollherzen, während sich demgegenüber das Fehlen von Myoglobin negativ auswirkt (vgl. auch die unten angebenen Originalarbeiten). Durch geeignete Kombination von transgenem Tiermodell und pharmakologischer Intervention können somit Experimente durchgefürt werden, die Hinweise auf eine effizientere Herzinfarkttherapie beim Menschen geben können. |
||||
| Nach oben |
In vivo 2D-Mapping des Energiestatus |
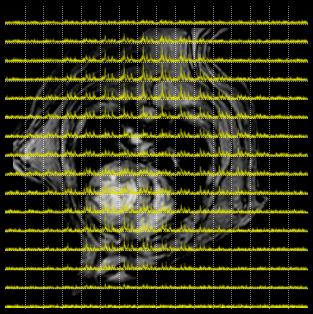
|
Die oben beschriebenen Untersuchungen zur Energetik am perfundierten Mäuseherz bieten den Vorteil, daß man hier nahezu vollständige Kontrolle über alle experimentellen Bedingungen hat. Andererseits haben sie den Nachteil, daß sie zum einen nicht unter "richtig" natürlichen Bedingungen durchgeführt werden und zum anderen auf Endpunktstudien beschränkt sind und somit keine wiederholten Messungen am selben Objekt erlauben. Insbesondere um Veränderungen im Energiestatus während eines Krankheitsverlaufs bzw. einer eingeleiteten Behandlung zu verfolgen, sind daher 31P-NMR-spektroskopische Untersuchungen unter tatsächlichen in vivo Bedingungen von großem Interesse.
Die Hauptschwierigkeit gegenüber der oben beschriebenen Vorgehensweise, bei der die 31P-NMR-Spektren ganz einfach über das gesamte sensitive Volumen aufgenommen werden, besteht hier darin, eine exakte Lokalisation der Spektren im Herzen zu gewährleisten und eine Kontamination von Signalen aus benachbartem Gewebe zu vermeiden. Hierfür "überzieht" man den Brustkorb der Maus mit einem spektroskopischen Gitter, das exakt mit dem anatomischen 1H-MR-Bild korreliert. Nebenstehende Abbildung zeigt exemplarisch die Überlagerung eines solchen 2D 31P-CSI Datensatzes (Chemical Shift Imaging → Theorie) und des entsprechenden Protonenbildes. Trotz der geringen Auflösung läßt sich klar erkennen, daß nur da, wo sich Gewebe befindet, 31P-Signale zu detektieren sind. |
|
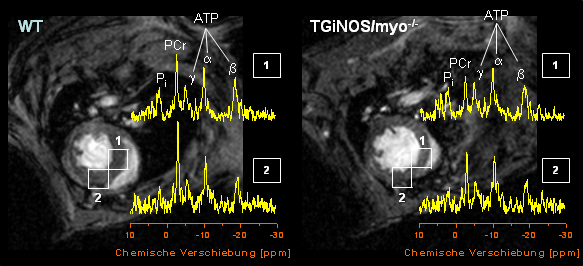
| Besonders intensive Signale finden sich in der Skelettmuskulatur des Rückens (im oberen Bereich der Abbildung) und in der Herzgegend, während im Bereich der Lungen aufgrund der geringen Dichte dieses Gewebes erwartungsgemäß nur wenig Signal detektiert wird. Dies läßt sich anhand einer detaillierteren Darstellung noch besser nachvollziehen. Exemplarische, ortsaufgelöste Spektren aus der Vorderwand und des Septums (Kammerscheidewand) eines normalen Mäuseherzens (WT=Wildtyp) sind auf der linken Hälfte der unteren Abbildung dargestellt. Das Spektrum aus der Vorderwand (2) ist gut vergleichbar mit den oben gezeigten 31P-NMR-Spektrum des isoliert perfundierten Herzens, während es bei Spektren aus der Herzscheidewand (1) in der Regel unvermeidbar ist, 31P-Signale aus dem Blut mitzuerfassen, was sich nicht nur in mehr oder weniger zusätzlichen Signalen im Bereich des anorganischen Phosphats (Pi) bemerkbar macht, sondern auch in einer scheinbaren Reduktion des PCr/ATP-Verhältnisses. | ||
| Verfolgt man nun mit diesem Verfahren die kardiale Energetik von Mäusen, bei denen durch genetische Manipulation eine Herzerkrankung ausgelöst worden ist, so stellt man fest, daß diese – ganz ähnlich wie beim Menschen – mit einer Störung des normalen Energiestatus einhergeht. Auf der rechten Seite der nebenstehenden Abbildung ist dies am Beispiel eines Mausstammes verdeutlicht, der aufgrund einer kardialen Überexpression der induzierbaren NO-Synthase und dem gleichzeitigen Fehlen von Myoglobin (TGiNOS/myo-/-, siehe auch den Abschnitt über Myoglobin und NO) durch das Auftreten einer Hypertrophie der linken Kammer gekennzeichnet ist, die im fortgeschrittenen Stadium sogar in eine Herzinsuffizienz münden kann (Gödecke et al, 2003). |
|
|
|
Der Vergleich der 31P-NMR-Spektren von TGiNOS/myo-/-- und WT-Herzen zeigt sowohl in der Vorderwand als auch im Septum deutlich niedrigere PCr-Spiegel für die Mutante, was eine limitierte Verfügbarkeit dieses "energetischen Puffers" widerspiegelt. Gleichzeitig ist im korrespondierenden 1H-MR-Bild bereits ein "Ausleiern" der linken Herzkammer erkennbar: Das enddiastolische Volumen der transgenen Maus (rechts) ist erheblich größer als in der gesunden Kontrollmaus (links). Eine exakte Auswertung der Herzfunktion anhand von dynamischen CineFLASH-Movies (siehe hier für eine Beschreibung der Methode) bestätigt den visuellen Eindruck und ergibt für die TGiNOS/myo-/--Herzen eine deutlich eingeschränkte Pumpleistung. Eine Überprüfung der am lebenden Tier erhobenen Daten zum Energiestatus anhand hochaufgelöster 31P-NMR-Spektroskopie nach Organentnahme liefert eine ausgezeichnete Übereinstimmung der in vivo und ex vivo erhaltenen Ergebnisse. Es ist bemerkenswert, daß das Ausmaß der hier beobachteten Störung des Energiehaushalts absolut vergleichbar mit den Veränderungen ist, die beim Menschen während der Entwicklung einer Herzinsuffizienz nachgewiesen worden sind (siehe Flögel et al, 2007 für mehr Details).
Durch den kombinierten Einsatz von 1H-MRI und 31P-CSI läßt sich somit ein recht vollständiges Bild von Herzfunktion und -energetik genetisch modifizierter Mauslinien gewinnen, die als Modell zur Erforschung der Ursachen menschlicher Herzerkrankungen dienen können. Aufgrund des nichtinvasiven Charakters dieser Untersuchungen ist es über repetitive Messreihen möglich, das Fortschreiten der Herzerkrankung zu beobachten und den Erfolg entsprechender Therapien zu beurteilen. |
||
| Nach oben |
Eigene Arbeiten zu Energetik und Funktion |
| Eine vollständige Übersicht über die in den letzten Jahren von uns publizierten Arbeiten finden Sie hier. Die Literaturstellen sind verlinkt mit den PubMed-Abstracts der National Library of Medicine. Wenn Sie Interesse an einer dieser Arbeiten und keinen Online-Zugang zu der entsprechenden Zeitschrift haben, senden Sie uns eine Email, damit wir Ihnen eine PDF-Datei zukommen lassen können. |
|
| Methodische Arbeiten |
| Flögel U, Jacoby C, Gödecke A, Schrader J. |
| In vivo 2D mapping of impaired murine cardiac energetics in NO-induced heart failure. |
| Magn Reson Med. 2007; 57: 50-8. |
| Flögel U, Decking UK, Gödecke A, Schrader J. |
| Contribution of NO to ischemia-reperfusion injury in the saline-perfused heart: a study in endothelial NO synthase knockout mice. |
| J Mol Cell Cardiol. 1999; 31: 827-36. |
| Anwendungen |
| Haddad S, Wang Y, Galy B, Korf-Klingebiel M, Hirsch V, Baru AM, Rostami F, Reboll MR, Heineke J, Flögel U, Groos S, Renner A, Toischer K, Zimmermann F, Engeli S, Jordan J, Bauersachs J, Hentze MW, Wollert KC, Kempf T. |
| Iron-regulatory proteins secure iron availability in cardiomyocytes to prevent heart failure. |
| Eur Heart J. 2017; 38: 362-372. |
| |
| Tucci S, Flögel U, Hermann S, Sturm M, Schäfers M, Spiekerkoetter U. |
| Development and pathomechanisms of cardiomyopathy in very long-chain acyl-CoA dehydrogenase deficient VLCAD(-/-) mice. |
| Biochim Biophys Acta 2014; 1842: 677-85. |
| Luedde M, Flögel U, Knorr M, Grundt C, Hippe HJ, Brors B, Frank D, Haselmann U, Antony C, Voelkers M, Schrader J, Most P, Lemmer B, Katus HA, Frey N. |
| Decreased contractility due to energy deprivation in a transgenic rat model of hypertrophic cardiomyopathy. |
| J Mol Med. 2009; 87: 411-22. |
| Rassaf T, Flögel U, Drexhage C, Hendgen-Cotta U, Kelm M, Schrader J. |
| Nitrite reductase function of deoxymyoglobin: oxygen sensor and regulator of cardiac energetics and function. |
| Circ Res. 2007; 100: 1749-54. |
| Flögel U, Gödecke A, Klotz LO, Schrader J. |
| Role of myoglobin in the antioxidant defense of the heart. |
| FASEB J. 2004; 18: 1156-8. |
| Warskulat U, Flögel U, Jacoby C, Hartwig HG, Thewissen M, Merx MW, Molojavyi A, Heller-Stilb B, Schrader J, Häussinger D. |
| Taurine transporter knockout depletes muscle taurine levels and results in severe skeletal muscle impairment but leaves cardiac function uncompromised. |
| FASEB J. 2004; 18: 577-9. |
| Wunderlich C, Flögel U, Gödecke A, Heger J, Schrader J. |
| Acute inhibition of myoglobin impairs contractility and energy state of iNOS-overexpressing hearts. |
| Circ Res. 2003; 92: 1352-8. |
| Gödecke A, Molojavyi A, Heger J, Flögel U, Ding Z, Jacoby C, Schrader J. |
| Myoglobin protects the heart from inducible nitric-oxide synthase iNOS-mediated nitrosative stress. |
| J Biol Chem. 2003; 278: 21761-6. |
| Merx MW, Flögel U, Stumpe T, Gödecke A, Decking UK, Schrader J. |
| Myoglobin facilitates oxygen diffusion. |
| FASEB J. 2001;15: 1077-9. |
| Flögel U, Merx MW, Gödecke A, Decking UK, Schrader J. |
| Myoglobin: A scavenger of bioactive NO. |
| Proc Natl Acad Sci USA. 2001; 98: 735-40. |
| Gödecke A, Flögel U, Zanger K, Ding Z, Hirchenhain J, Decking UK, Schrader J. |
| Disruption of myoglobin in mice induces multiple compensatory mechanisms. |
| Proc Natl Acad Sci USA. 1999; 96: 10495-500. |
|
|||