
 |
| | ||||
| Substratnutzung | Global | Stoffwechsel (II) | ||
| Körperfett | Organspezifisch | |||
| VLCAD | ||||
| Publikationen | ||||
|
Analyse der Körperfettzusammensetzung |
||||
| Im Gegensatz zu den unter Substratnutzung beschriebenen Untersuchungen zum Intermediärstoffwechsel, wo unter anderem aufgrund der geringen Konzentration der interessierenden Metabolite der Einsatz 13C-angereicherter Substrate unabdingbar ist, läßt sich zur Analyse maßgeblicher Aspekte des Lipidstoffwechsels das in den langen Fettsäureketten in natürlicher Häufigkeit vorkommende 13C nutzen (≈ 1%). Mithilfe einer 13C-Oberflächenspule, die zusätzlich in den normalen 1H-Resonator eingefügt wird, erhält man in akzeptabler Meßzeit (≤ 20 min) 13C-MR-Spektren, aus denen zahlreiche Informationen über die Zusammensetzung der im Fettgewebe deponierten Triacylglyceride entnommen werden können. | ||||
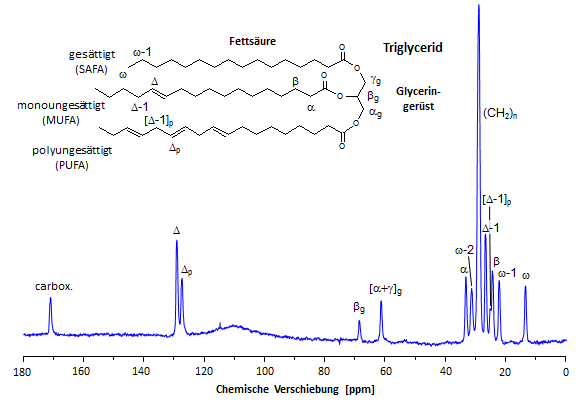
|
Wie aus nebenstehender Abbildung ersichtlich, können insbesondere die Kohlenstoffe der Fettsäuren zu den beiden Kettenenden hin (ω, ω-1, ω-2 beziehungsweise α, carboxylisch) spektral hervorragend aufgelöst werden. Außerdem erkennt man in der Zuckerregion Signale für die Kohlenstoffe des Glycerinrückens (αg + γg sowie βg), wobei αg + γg in der Regel nicht getrennt werden können. Darüber hinaus erhält man im olefinischen Bereich diskrete Signale für mono- und polyungesättigte Fettsäuren (Δ und Δp). Nach Integration und Korrektur der individuellen Signale für partielle Sättigung (aufgrund der Aufnahme nicht vollständig relaxierter Spektren) künnen diese zur Berechnung des relativen Anteils gesättigter, mono- und polyungesättigter Fettsäuren (SAFA, MUFA, PUFA) in den gespeicherten Triglyceriden genutzt werden. Außerdem läßt sich aus dem Intensitätsverhältnis der Summe aller zu den terminalen Fettsäurekohlenstoffen die mittlere Kettenlänge (KL) der in die Triglyceride eingebauten Fettsäuren ermitteln (→ mehr Details). |
|||
|
Da die in den Adipocyten abgelagerten Triglyceride das biochemische Schicksal der aufgenommenen Fettsäuren über einen längeren Zeitraum widerspiegeln und somit im Prinzip eine Art Stoffwechselintegral darstellen, eignet sich diese Technik somit hervorragend, um metabolische Langzeitauswirkungen der Ernährung auf den Lipidstoffwechsel zu untersuchen. Eine praktische Anwendung ist weiter unten am Beispiel eines Defekts in der β-Oxidation beschrieben. |
||||
| Nach oben |
Organspezifische Lipidanalyse |
| Im obigen Abschnitt erfolgte die Aufnahme der Spektren zur Untersuchung der Fettzusammensetzung aufgrund der geringen natürlichen Häufigkeit des 13C-Isotops über das gesamte Abdomen – für eine volumenselektive Lipiduntersuchung reicht die Sensitivität dieser Methode jedoch nicht aus; hier bestünde nur bei einer kostenintensiven Langzeitfütterung mit 13C-markierten Substraten Aussicht auf Erfolg. Alternativ können für eine Charakterisierung von Lipidgehalt und -zusammensetzung auf Organebene auch protonenspektroskopische Methoden eingesetzt werden. | ||
|
Wie aus nebenstehender Abbildung ersichtlich, erlaubt die hohe Empfindlichkeit des 1H-Kerns die Spektrenakquisition zur Analyse individueller Fettkompartimente aus vergleichsweise kleinen Volumenelementen. Das dargestellte Spektrum ist mit einer PRESS-Sequenz (PRESS = Point Resolved Spectroscopy) ohne Wasserunterdrückung aber mit Outer Volume Suppression aus einem im viszeralen Fett platzierten Voxel von 3x3x3 mm3 (vergleiche die Lage des violetten Rechtecks) innerhalb von knapp einer Minute aufgenommen worden. Allerdings zeigt sich hier auch gleich der Nachteil dieser Vorgehensweise: Die im Vergleich zu den oben gezeigten 13C-MR-Spektren erheblich geringere spektrale Breite der Protonenspektren (≈ 5 gegenüber fast 200 ppm) führt zu einer deutlich schlechteren Trennung und damit zu einer stärkeren Überlappung der Signale für die einzelnen Triglycerideinheiten. Auf der anderen Seite reicht die Auflösung der 1H-MR-Spektren völlig aus, um anhand des gut separierten doppelallylischen Protonensignals [Δ-1]p bei 2.8 ppm – als Gradmesser für den PUFA-Anteil – Unterschiede im Sättigungsgrad der im Gewebe deponierten Fettsäuren auf Organebene zu analysieren. |
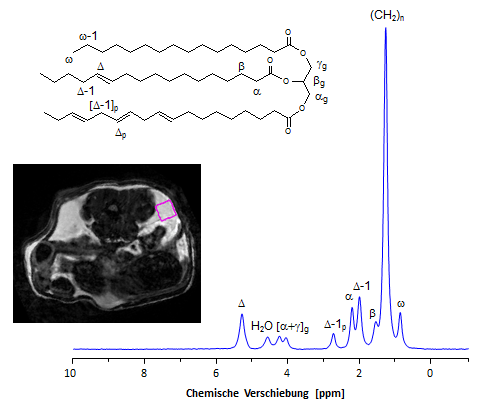
|
|
| Bei Verzicht auf eine Wasserunterdrückung während der Spektrenakquisition kann zudem aus dem Verhältnis von Fett- und Wassersignalen gleichzeitig der relative Fettgehalt des Organs ermittelt werden (siehe unten). | ||
| Nach oben |
Therapie eines angeborenen Stoffwechseldefekts in der β-Oxidation |
|
Die oben beschriebenen Techniken wurde in einer Kooperation mit der Kinderklinik dazu genutzt, die Auswirkungen einer bislang als gut verträglich geltenden Diät zur Therapie von angeborenen Fehlern im Stoffwechsel langkettiger Fettsäuren zu untersuchen. Durch einen Defekt in der β-Oxidation (vor allem in der VLCAD = Very Long-Chain Acyl-CoA Dehydrogenase) sind diese Patienten nicht in der Lage, Fettsäuren mit einer Kettenlänge von mehr als 16 Kohlenstoffatomen für die Energiegewinnung zu nutzen. Da insbesondere das Herz zur Finanzierung seines permanent hohen Energiebedarfs auf die Verbrennung von Fettsäuren angewiesen ist, überrascht es nicht, daß ein solcher genetischer Defekt der Ausbildung einer Kardiomyopathie Vorschub leistet.
Um zu vermeiden, daß die betroffenen Patienten metabolisch entgleisen, wird eine Diät mit mittelkettigen Fettsäuren (MCT = Medium-Chain Triglycerides) verordnet, die unter Umgehung des "langkettigen Flaschenhalses" unmittelbar für die Energieproduktion in der β-Oxidation genutzt werden können. Diese Therapie hat sich über den bisherigen Beobachtungszeitraum in der Tat als erfolgreich erwiesen, um die Entwicklung von Herz- und auch Skelettmuskelerkrankungen weitgehend einzudämmen, doch ist zur Zeit noch völlig unklar, welche Konsequenzen die Langzeitumstellung der Ernährung für den normalen Lipidstoffwechsel nach sich zieht. Zur Untersuchung dieser Fragestellung wurden transgene Mäuse mit einem der humanen Erkrankung analogen Gendefekts (VLCAD-/-) für ein Jahr ausschließlich mit MCT-Futter ernährt und mit gleichaltrigen VLCAD-/--Mäusen, die normales Futter erhielten (LCT = Long-Chain Triglycerides), sowie mit zwei altersgematchten Wildtyp-Gruppen verglichen, die ebenfalls beiden Diäten für ein Jahr ausgesetzt waren. Anschließend wurde der Effekt dieser Langzeit-MCT-Diät auf die Fettverteilung der verschiedenen Spezies analysiert. Dabei zeigte sich zum einen, daß VLCAD-/--Mäuse unter MCT-Diät einen deutlich höheren Fettgehalt pro Körpervolumen als alle anderen untersuchten Spezies aufweisen (Tucci et al. 2011). |
||
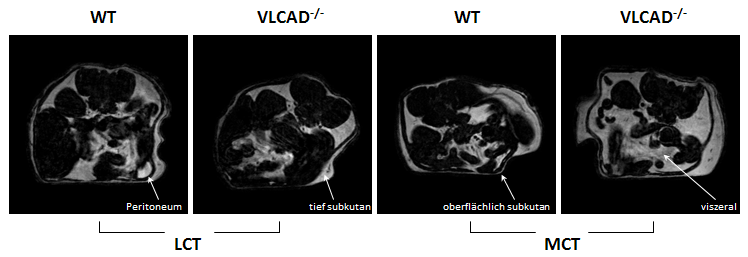 | Des Weiteren ergab die Klassifizierung des abdominalen Fetts anhand fettselektiver MR-Bilder (links), daß dies insbesondere durch eine Zunahme des viszeralen Fetts und nur in untergeordnetem Maße durch Veränderungen im subkutanen Fett bedingt war, was Zweifel an der Langzeitverträglichkeit der MCT-Diät für Patienten mit diesem Defekt aufwirft. | |
|
Parallel zu den oben beschriebenen Bildgebungsexperimenten wurden in allen vier Gruppen (WT und VLCAD-/- unter LCT- beziehungsweise MCT-Diät) 13C-MR-Spektren zur Analyse der abdominellen Fettzusammensetzung aufgenommen. Untenstehende Abbildung zeigt charakteristische Spektren von VLCAD-/--Mäusen, die ein Jahr nach LCT- beziehungsweise MCT-Fütterung gewonnen wurden. Dabei fällt in erster Linie die dramatische Abnahme der Signalintensität für die polyungesättigten Kohlenstoffe (Δp, [Δ-1]p) ins Auge. |
||
| Nach Quantifizierung der Spektren stellte sich heraus, daß der Anteil der PUFA unter MCT-Diät bis auf etwa 10% im Vergleich zu circa 50% unter Kontrollbedingungen absank. Gleichzeitig war ein massiver Anstieg der MUFA sowie eine moderate Zunahme der gesättigten Fettsäurespiegel zu verzeichnen. Diese Effekte waren allerdings nicht spezifisch für die VLCAD-/--Mäuse, sondern wurden ebenso in WT-Tieren beobachtet (siehe die quantitative Auswertung dieses Experiments). Überraschenderweise hatte die MCT-Fütterung jedoch in beiden Gruppen lediglich einen marginalen Einfluß auf die Kettenlänge der im Abdomen gespeicherten Fettsäuren. Obwohl diese Diät im Wesentlichen C8- und C10-Triacylglyeride beeinhaltet, befand sich die mittlere Fettsäurenlänge der ins abdominale Gewebe inkorporierten Triacylglyceride immer noch im Bereich von 16-17 Kohlenstoffen – selbst nach einer Fütterung mit dieser Diät über ein Jahr (siehe Auswertung dieser Experimente). | 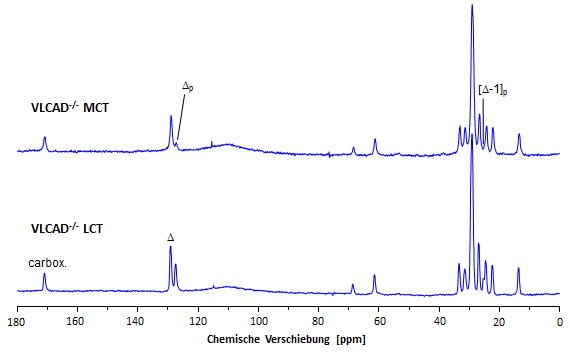 |
|
|
Aus diesen Messungen lassen sich zunächst zwei wichtige Schlußfolgerungen ableiten: Zum einen führt die langfristige Einnahme von mittelkettigen Triglyceriden zu einer drastischen Entleerung der körpereigenen Reserven an PUFA, denen in einer Vielzahl von Studien protektive Eigenschaften zugeschrieben werden. Zum anderen werden die mit der Nahrung aufgenommenen mittelkettigen Fettsäuren im Körper offenbar zu langkettigen Fettsäuren umgewandelt – ein Prozeß, der normalerweise vor allem in der Leber stattfindet. Da jedoch die verlängerten Fettsäuren bei VLCAD-Defizienz nur eingeschränkt metabolisiert werden können, sollte dies zu einem verstärkten Rückstau der nicht verwertbaren Lipide in den transgenen Tiere führen. Demnach wurde im letzten Schritt der MR-Fettuntersuchung auch Lipidgehalt und -zusammensetzung der Leber unter den verschiedenen Fütterungsbedingungen in WT- und VLCAD-/--Tieren bestimmt. |
||
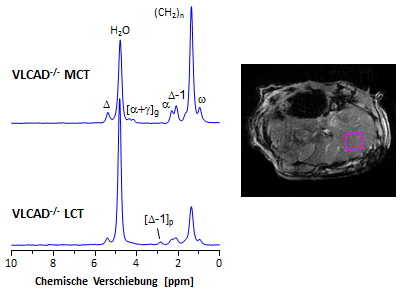 | In nebenstehender Abbildung sind typische 1H-MR-Spektren aus dem rechten Leberlappen (Lokalisation → Rechteck) von VLCAD-/--Mäusen dargestellt, die nach einjähriger LCT- beziehungsweise MCT-Diät aufgenommen wurden. Bereits auf den ersten Blick wird deutlich, daß die MCT-Fütterung in der Mutante fatale Auswirkungen auf die Lipidhomöostase der Leber hat. Aus den Intensitätsveränderungen der Signale für Wasser und Fett ist klar ersichtlich, daß es dort zu einer massiven Lipidakkumulation kommt, während der nahezu vollständige Verlust des Signals für [Δ-1]p die starke Verringerung der hepatischen PUFA-Spiegel widerspiegelt, die auch über den gesamten abdominalen Bereich beobachtet wurde (vergleiche vorherigen Abschnitt). Die Quantifizierung der Spektren ergab eine Verdopplung des Fettgehalts in der Leber der transgenen Tiere, während in WT-Mäusen unter MCT-Diät lediglich ein Trend zu einer Zunahme des Leberfettgehalts beobachtet wurde, die jedoch nicht das Signifikanzniveau erreichte (siehe Tucci et al. 2011 für eine ausführliche Darstellung der Ergebnisse). |
|
|
Zusammengefaßt zeigen die Ergebnisse aus den kombinierten Bildgebungs- und Spektroskopieexperimenten, daß VLCAD-/--Mäuse nach einem Jahr MCT-Fütterung einen schweren klinischen Phänotyp ähnlich der nichtalkoholischen Fettleber und dem metabolischen Syndrom entwickeln, der mit einer massiven viszeralen und hepatischen Fetteinlagerung einhergeht. Überdies führt die Langzeit-MCT-Diät zu einer drastischen Verschiebung der Triglyceridzusammensetzung im gesamten Abdomen, die einen starken Abfall im Spiegel der physiologisch wichtigen polyungesättigten Fettsäuren zur Folge hat. Die schwerwiegenden Auswirkungen, die durch die modifizierte Triglyceridkomposition der MCT-Diät hervorgerufen wurden, sind insbesondere überraschend angesichts der Tatsache, daß der Gesamtfettgehalt in beiden Diäten gleich war. Allerdings unterscheidet sich der Stoffwechsel von MCTs in einigen wesentlichen Aspekten von dem der normalen LCTs. MCTs werden deutlich schneller zu freien Fettsäuren hydrolysiert und dementsprechend rasch im gastrointestinalen Trakt absorbiert. Im Gegensatz zu langkettigen werden mittelkettige Fettsäuren (LCFA beziehungsweise MCFA = Long- or Medium-Chain Fatty Acid) nur zu einem geringen Teil in Chylomicronen verpackt, sondern werden überwiegend unverestert aus den Enterocyten in den Pfortaderkreislauf entlassen und können daher leicht für die Energiegewinnung im Herz- und Skelettmuskel abgerufen werden.
An dieser Stelle ist es wichtig festzuhalten, daß überschüssige MCFAs nicht als MCTs in Adipocyten gespeichert werden: Die 13C-MRS-Analyse der mittleren Fettsäurenkettenlänge im Abdomen zeigte – selbst nach einem Jahr MCT-Fütterung – lediglich eine leichte Verkürzung der Kohlenstoffketten im Vergleich zur LCT-Diät. Dies befindet sich im Einklang mit früheren Befunden über eine nur geringe Aufnahme von MCFAs in die Adipocyten. Überschüssige MCFAs werden daher primär zur Leber transportiert, wo sie entweder (i) via β-Oxidation zu C2-Fragmenten und Ketonkörpern umgewandelt oder (ii) zu LCFAs verlängert und anschließend zu LCTs verestert werden können. Wie aus der unter beiden Diäten nahezu unveränderten Kettenlänge der abdominal gespeicherten Fettsäuren hervorgeht, dominiert im vorliegenden Fall eindeutig der letztere Weg. Da die verlängerten Fettsäuren in VLCAD-defizienten Mäusen nicht für die Energieproduktion genutzt werden können, führt dies in der Mutante zu einer massiven Lipidakkumulation, was auf lange Sicht für die Leber aufgrund der permanenten Belastung durch gesteigerte Zufuhr und Prozessierung von MCFAs einen metabolischen Teufelskreis darstellt. Vom klinischen Standpunkt aus gesehen, hat sich die Gabe von MCTs zur Eindämmung von Herz- und Muskelerkrankungen bei Defekten in der Verwertung langkettiger Fettsäuren bewährt, in dem – durch Überbrückung des "metabolischen Flaschenhalses" in der β-Oxidation – die Organe, die auf Fettsäuren als Hauptenergiequelle angewiesen sind, mit den benötigten Substraten versorgt werden. Bis jetzt wurden dabei keine ernsthaften Nebenwirkungen beobachtet; allerdings sind bislang keine belastbaren Daten aus Langzeituntersuchungen verfügbar. Auf der anderen Seite geht aus einigen Kurzzeitstudien hervor, daß MCT-Diäten aufgrund der eingeschränkten Deposition von MCFAs im Fettgewebe auch erfolgreich zur Adipositas-Behandlung eingesetzt werden könnten. Der gesteigerte Energiebedarf für die oben beobachtete Verlängerung der MCFAs kann in der Tat zu einem kurzfristigen Gewichtsverlust beitragen, doch die dauerhaft erhöhte Fettzufuhr in die Leber steigert unweigerlich das Risiko für die Ausbildung einer Steatohepatitis. Es ist daher nicht überraschend, daß in der Literatur über das Auftreten einer Fettleber während ketogener MCT-Diät bei unheilbarer Epilepsie berichtet wird. Bei zusätzlichem Vorliegen eines Defekts im Fettsäurestoffwechsel führt der verstärkte MCFA-Zufluß in die Leber jedoch nicht nur zu einer Steatose, sondern vielmehr zu den klinischen Charakteristiken des metabolischen Syndroms. Da aufgrund der weltweiten Neugeborenen-Screening-Programme zunehmend mehr angeborene Stoffwechselfehler entdeckt werden und neben symptomatischen auch asymptomatische Kinder bereits im neonatalen Alter mit MCTs supplementiert werden, erscheint ein regelmäßiges Screening der betroffenen Patienten auf mögliche Lebererkrankungen zwingend angezeigt. Für die nichtinvasive Kontrolle auf Veränderungen von Verteilung und Zusammensetzung des Körperfetts könnten die hier für die Maus beschriebenen MR-Techniken problemlos auf klinische MR-Scanner übertragen werden. |
||
| Nach oben |
Eigene Arbeiten zur in vivo Analyse des Lipidstoffwechsels |
| Eine vollständige Übersicht über die in den letzten Jahren von uns publizierten Arbeiten finden Sie hier. Die Literaturstellen sind verlinkt mit den PubMed-Abstracts der National Library of Medicine. Wenn Sie Interesse an einer dieser Arbeiten und keinen Online-Zugang zu der entsprechenden Zeitschrift haben, senden Sie uns eine Email, damit wir Ihnen eine PDF-Datei zukommen lassen können. |
| Weske S, Vaidya M, Reese A, von Wnuck Lipinski K, Keul P, Bayer JK, Fischer JW, Flögel U, Nelsen J, Epple M, Scatena M, Schwedhelm E, Dörr M, Völzke H, Moritz E, Hannemann A, Rauch BH, Gräler MH, Heusch G, Levkau B. |
| Targeting sphingosine-1-phosphate lyase as an anabolic therapy for bone loss. |
| Nat Med. 2018; 24: 667-678. |
| |
| Hendgen-Cotta UB, Esfeld S, Coman C, Ahrends R, Klein-Hitpass L, Flögel U, Rassaf T, Totzeck M. |
| A novel physiological role for cardiac myoglobin in lipid metabolism. |
| Sci Rep. 2017; 7: 43219 (13 pages). |
| |
| Jelenik T, Kaul K, Séquaris G, Flögel U, Phielix E, Kotzka J, Knebel B, Fahlbusch P, Hörbelt T, Lehr S, Reinbeck AL, Müller-Wieland D, Esposito I, Shulman GI, Szendroedi J, Roden M. |
| Mechanisms of insulin resistance in primary and secondary non-alcoholic fatty liver. |
| Diabetes. 2017; 66: 2241-2253. |
| |
| Tucci S, Flögel U, Beermann F, Behringer S, Spiekerkoetter U. |
| Triheptanoin: long-term effects in the very long-chain acyl-CoA dehydrogenase-deficient mouse. |
| J Lipid Res. 2017; 58: 196-207. |
| |
| Tucci S, Flögel U, Hermann S, Sturm M, Schäfers M, Spiekerkoetter U. |
| Development and pathomechanisms of cardiomyopathy in very long-chain acyl-CoA dehydrogenase deficient VLCAD(-/-) mice. |
| Biochim Biophys Acta. 2014; 1842: 677-85. |
| |
| Burghoff S, Flögel U, Bongardt S, Burkart V, Sell H, Tucci S, Ikels K, Eberhard D, Kern M, Klöting N, Eckel J. |
| Deletion of CD73 promotes dyslipidemia and intramyocellular lipid accumulation in muscle of mice. |
| Arch Physiol Biochem. 2013; 119: 39-51. |
| |
| Tucci S, Flögel U, Sturm M, Borsch E, Spiekerkoetter U. |
| Disrupted fat distribution and composition due to medium-chain triglycerides in mice with a β-oxidation defect |
| Am J Clin Nutr. 2011; 94: 439-49. |
|
|||