
 |
| | ||
| Über Fluor | Bildgebung über den Fluorkern | |
| Entzündungen | ||
| Herz | ||
| Gehirn | ||
| Publikationen | ||
|
Warum Fluor? |
||
|
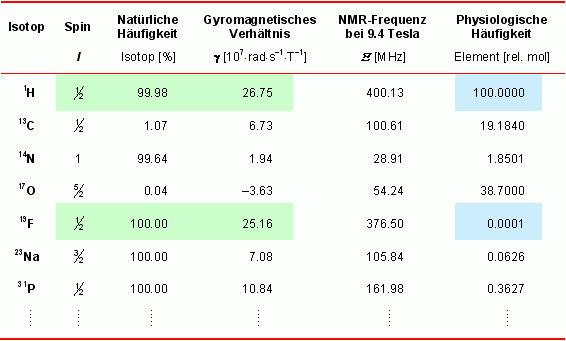
Die nebenstehende Tabelle listet MR-relevante Eigenschaften einiger biologisch wichtiger Atomkerne auf. Für die MR-Empfindlichkeit eines Kerns ist sein gyromagnetisches Verhältnis γ das entscheidende Maß. Wie aus der Tabelle ersichtlich, ist das natürlich vorkommende, stabile Fluorisotop 19F (100%) MR-aktiv und weist eine ähnliche Empfindlichkeit wie der für anatomische Bildgebung genutzte 1H-Kern auf. Gleichzeitig ist jedoch sein Vorkommen im Organismus verschwindend gering.
Durch das nahezu vollständige Fehlen eines natürlichen 19F-Hintergrundes im Körper sind daher detektierte Signale von injizierten 19F-beinhaltenden Substanzen hochspezifisch. Eine exakte anatomische Lokalisation der 19F-haltigen Verbindungen innerhalb des Körpers läßt sich ganz einfach durch Aufnahme morphologisch übereinstimmender 1H- und 19F-MR-Bilder und anschließender Überlagerung der anatomisch korrespondierenden Bilder vornehmen (siehe unten). |
|
|
| Nach oben |
Erkennung von Entzündungsherden mithilfe von Perfluorcarbonen |
| Entzündungen sind mit einer großen Zahl von Erkrankungen wie Atherosklerose, Glomerulonephritis, Colitis, Transplantatabstoßung, Hirn- und Rückenmarkstraumen, Myokarditis, koronarer Herzkrankheit etc. verbunden. Obgleich das medizinische Problem weit verbreitet ist, sind zur Zeit die Diagnosemöglichkeiten – insbesondere wenn innere Organe betroffen sind – limitiert und damit die Therapie oft auf die Eindämmung der Symptome beschränkt. Nichtinvasive bildgebende Verfahren wie Echokardiographie, PET, CT, SPECT und MRT liefern zwar detaillierte anatomische Informationen und sind dadurch wertvolle Hilfsmittel zur Beurteilung von Organfunktionen. Allerdings ist es bis jetzt mit keinem der genannten Verfahren eindeutig möglich, entzündliche Vorgänge mit hoher räumlicher Auflösung nachzuweisen, da speziell in der initialen Phase der Erkrankung das betroffene Gewebe keine spezifischen physikalischen Eigenschaften aufweist, die zur Kontrasterzeugung zwischen gesunden und entzündeten Arealen genutzt werden können. | ||
|
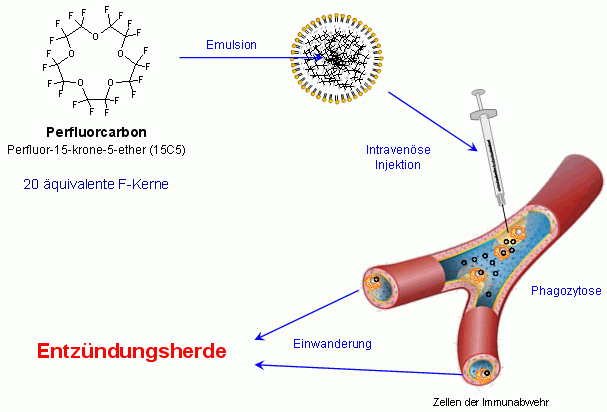
Aus diesem Grund haben wir ein neues Verfahren entwickelt (siehe Schema), um entzündliche Prozesse über einen eindeutig positiven Kontrast mittels 19F-MRT nachzuweisen. Als Kontrastmittel haben wir Nanopartikel verwendet, die Perfluorcarbone (PFCs) enthalten – eine Substanzfamilie, die bekanntermaßen biochemisch inert ist (z.B. Teflon). Einige Mitglieder dieser Substanzklasse, wie Perfluordecalin und Perfluoroctylbromid (auch bekannt als Oxygent®) wurden bereits klinisch als künstliche Blutersatzstoffe eingesetzt.
In unseren bisherigen Untersuchungen haben wir jedoch das PFC Perfluor-15-krone-5-ether eingesetzt, in dem alle 20 Fluorkerne chemisch sowie magnetisch äquivalent sind (siehe nebenstehende Strukturformel) und das dadurch überlegene Eigenschaften für die Detektion mittels 19F-MRT aufweist. Diese Substanz ist eine völlig wasserunlösliche Flüssigkeit und muß daher zum Einbringen in die Blutbahn emulgiert werden. Die Partikelgröße der Emulsion wurde so gewählt, daß eine optimale Aufnahme durch die Immunabwehr des Körpers gewährleistet sein sollte. |
|
| Nach intravenöser Gabe der emulgierten PFCs erfolgt in der Tat eine effiziente und selektive Aufnahme des Kontrastmittels durch zirkulierende Zellen des Monozyten/Makrophagen-Systems (siehe obenstehendes Schema), wie anhand umfangreicher Untersuchungen an Gewebe und Blut (→ mehr Details) zweifelsfrei nachgewiesen wurde (Flögel et al, 2008). Die Einwanderung der 19F-beladenen, immunokompetenten Zellen in entzündetes Gewebe ermöglicht dann eine eindeutige Identifikation der betroffenen Areale mittels kombinierter 1H/19F-MRT in vivo. Dies ist im folgenden an zwei unabhängigen akuten Inflammationsmodellen in der Maus dargestellt. | ||
| Nach oben |
Verfolgung inflammatorischer Prozesse nach Myokardinfarkt |
|
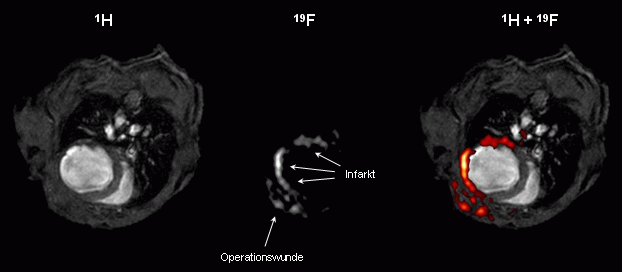
Nebenstehende Abbildungen zeigen MRT-Aufnahmen vom Brustkorb einer Maus nach Auslösen eines Herzinfarkts durch Verschluß einer Koronararterie – eine Prozedur, von der bekannt ist, daß durch sie eine akute Entzündunsgreaktion im betroffenen Gewebe hervorgerufen wird.
Die obere Bildreihe illustriert das Prinzip des kombinierten 1H/19F-MR-Ansatzes: Im 1H-Bild ist deutlich die Ausdünnung der linken Herzwand aufgrund des Infarktes zu sehen, und im korrespondierenden 19F-Bild läßt sich ein Muster erkennen, das der Form der linken Herzwand entspricht. Nach Überlagerung des 1H- mit dem 19F-MR-Bild (rote Farbcodierung) zeigt sich eindeutig, daß eine Anreicherung der PFCs in den verletzten Arealen des Herzens (Hinter- und Seitenwand) sowie in der Region des Brustkorbs, die für den experimentellen Eingriff eröffnet wurde, erfolgt. Aufgrund des Fehlens eines natürlichen 19F-Hintergrundes sind die beobachteten Signale hochspezifisch. Anschließende immunohistochemische Untersuchungen bestätigten die Infiltration von PFC-beladenen Monozyten/Makrophagen in die entzündeten Regionen (Flögel et al, 2008). |
|
|
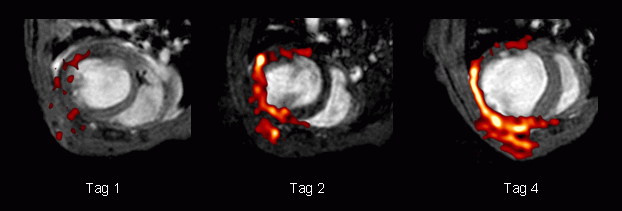
| Mithilfe repetitiver Messungen lassen sich somit die Auswirkungen des Eingriffs auf verschiedenen Ebenen dokumentieren (untere Bildreihe): Die enddiastolischen 1H-Bilder (aufgenommen 1, 2 und 4 Tage nach Verschluß des Koronargefäßes) veranschaulichen die fortschreitende linksventrikuläre Dilatation infolge des Infarkts. Die Überlagerung mit den entsprechenden 19F-Bildern (rot) demonstriert die kontinuierliche Anreicherung der PFCs und damit die progressive Rekrutierung immunkompetenter Zellen in die geschädigten Regionen des Herzens und der Brust. Detektierte 19F-Signale sind beschränkt auf Areale nahe des infarzierten Bereichs im Herzen; zu keiner Zeit wurde eine Infiltration der PFCs ins Septum oder den rechten Ventrikel beobachtet. Die zur Aufnahme der 19F-Bilder verwendete Pulssequenz (RARE, Rapid Acquisition with Relaxation Enhancement) vermeidet die Erfassung von Signalen aus fließenden Blutpartikeln, so daß die detektierten 19F-Signale eindeutig im Gewebe deponierten Nanopartikeln zugeordnet werden können und eine Kontamination durch Signale von zirkulierenden PFCs nicht befürchtet werden muß. | ||
| Nach oben |
Nachweis von Entzündungen nach zerebraler Ischämie |
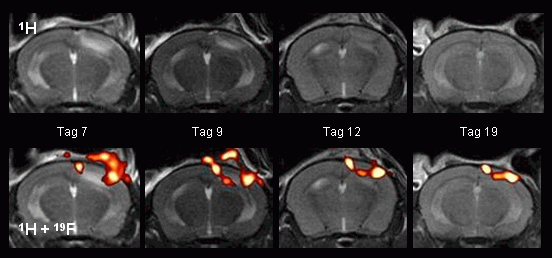
|
In unabhängigen Experimenten wurde die Folgen einer fokalen zerebralen Ischämie durch Photothrombose untersucht. Von diesem Schlaganfallmodell ist ebenfalls bekannt, daß es mit akuten Entzündungsprozeßen assoziiert ist.
Nach Auslösen des Hirninfarkts hebt sich in RARE 1H-Bildern die ischämische Region zu Anfang mit einem hellen Kontrast vom ungeschädigten Gewebe ab (siehe nebenstehende Abbildung oben links), doch dieser Kontrast verschwindet nach etwa einer Woche und der betroffene Bereich läßt sich anschließend in den 1H-Bildern nur noch schwer identifizieren. Bereits nach wenigen Tagen ist in den anatomisch übereinstimmenden 19F-Bildern deutlich die Einwanderung der PFCs in die Randzone des Infarktes zu beobachten (unten). |
|
|
Ganz ähnlich wie im vorigen Kapitel beschrieben, wird auch hier an der Stelle ein 19F-Signal beobachtet, an der im Rahmen des experimentellen Modells ein chirurgischer Einschnitt vorgenommen wurde (hier an der Schädelaußenseite, siehe obenstehende Abbildung links unten). Wie aus den repetitiven MR-Untersuchungen an Tag 7, 9, 12 und 19 nach Ischämie zu erkennen ist, kommt es in der Folgezeit dann zu eine Verschiebung der PFCs mit der Randzone des schrumpfenden Infarkts. Ebenso wie in den im vorhergehenden Kapitel beschriebenen Experimenten am Herzen, bestätigten auch hier anschließende immunohistochemische Untersuchungen die Infiltration von PFC-beladenen Monozyten/Makrophagen in die entzündeten Regionen (Flögel et al, 2008). Darüber hinaus befinden sich für beide experimentelle Modelle die von uns mittels des kombinierten 1H/19F-MR-Ansatzes erhaltenen Daten sowohl hinsichtlich des Zeitverlaufs der Akkumulation als auch der Lokalisation der PFC-beladenen Monozyten/Makrophagen innerhalb der ischämischen Areale in guter Übereinstimmung mit vorhergehenden Untersuchungen zum Myokard- bzw. Hirninfarkt.
Zusammengefaßt zeigen diese Ergebnisse, daß intravenös applizierte, emulgierte PFCs nach Phagozytose durch das Monozyten/Makrophagen-System in inflammatorischen Arealen akkumulieren und sich mittels MRT nachweisen lassen. Die PFCs stellen somit ein "positives" Kontrastmittel für Entzündungsprozeße dar, das aufgrund eines fehlenden natürlichen 19F-Hintergrundes ein hohes Maß an Spezifität aufweist. Da PFCs nicht toxisch sind, sollte sich dieses Verfahren auch für die Anwendung am Menschen eignen. |
||
| Nach oben |
Eigene Arbeiten zur Fluorbildgebung |
| Eine vollständige Übersicht über die in den letzten Jahren von uns publizierten Arbeiten finden Sie hier. Die Literaturstellen sind verlinkt mit den PubMed-Abstracts der National Library of Medicine. Wenn Sie Interesse an einer dieser Arbeiten und keinen Online-Zugang zu der entsprechenden Zeitschrift haben, senden Sie uns eine Email, damit wir Ihnen eine PDF-Datei zukommen lassen können. |
|
| Methodische Arbeiten |
| Temme S, Grapentin C, Quast C, Jacoby C, Grandoch M, Ding Z, Owenier C, Mayenfels F, Fischer JW, Schubert R, Schrader J, Flögel U. |
| Noninvasive imaging of early venous thrombosis by 19F magnetic resonance imaging with targeted perfluorocarbon nanoemulsions. |
| Circulation. 2015; 131: 1405-14. |
| Jacoby C, Temme S, Mayenfels F, Benoit N, Krafft MP, Schubert R, Schrader J, Flögel U. |
| Probing different perfluorocarbons for in vivo inflammation imaging by 19F MRI: image reconstruction, biological half-lives and sensitivity. |
| NMR Biomed. 2014; 27: 261-71. |
| Flögel U, Ding Z, Hardung H, Jander S, Reichmann G, Jacoby C, Schubert R, Schrader J. |
| In vivo monitoring of inflammation after cardiac and cerebral ischemia by fluorine magnetic resonance imaging. |
| Circulation. 2008; 118: 140-8. |
| Übersichtsarbeiten und Buchkapitel |
| Temme S, Grapentin C, Güden-Silber T, Flögel U. |
| Active targeting of perfluorocarbon nanoemulsions. |
| In: Fluorine Magnetic Resonance Imaging. Edited by Flögel U, Ahrens E; Pan Stanford Publishing, Singapore. 2016: 103-39. |
| Güden-Silber T, Temme S, Jacoby C, Flögel U. |
| Biomedical 19F MRI using perfluorocarbons. |
| Methods Mol Biol. 2018; 1718: 235-257. |
| |
| Grapentin C, Mayenfels F, Barnert S, Süss, Schubert R, Temme S, Jacoby C, Schrader J, Flögel U. |
| Optimization of perfluorocarbon nanoemulsions for molecular imaging by 19F MRI. |
| In: Nanomedicine. Edited by Seifalin A, de Mel A, Kalaskar DM; One Central Press, Manchester. 2014: 268-86. |
| Temme S, Bönner F, Schrader J, Flögel U. |
| 19F magnetic resonance imaging of endogenous macrophages in inflammation. |
| Wiley Interdiscip Rev Nanomed Nanobiotechnol. 2012; 4: 329-43. |
| Anwendungen |
| Flögel U, Schlüter A, Jacoby C, Temme S, Banga JP, Eckstein A, Schrader J, Berchner-Pfannschmidt U. |
| Multimodal assessment of orbital immune cell infiltration and tissue remodeling during development of graves disease by 1H/19F MRI. |
| Magn Reson Med. 2018; 80: 711-718. |
| |
| Ding Z, Temme S, Quast C, Friebe D, Jacoby C, Zanger K, Bidmon HJ, Grapentin C, Schubert R, Flögel U, Schrader J. |
| Epicardium-derived cells formed after myocardial injury display phagocytic activity permitting in vivo labeling and tracking. |
| Stem Cells Transl Med. 2016; 5: 639-650. |
| |
| Temme S, Jacoby C, Ding Z, Bönner F, Borg N, Schrader J, Flögel U. |
| Monitoring the trafficking of neutrophil granulocytes and monocytes during the course of tissue inflammation by noninvasive 19F MRI. |
| J Leukoc Biol. 2014; 95: 689-97. |
| Jacoby C, Borg N, Heusch P, Sauter M, Bönner F, Kandolf R, Klingel K, Schrader J, Flögel U. |
| Visualization of immune cell infiltration in experimental viral myocarditis by 19F MRI in vivo. |
| Magn Reson Mater Phy. 2014; 27: 101-6. |
| Flögel U, Burghoff S, van Lent PL, Temme S, Galbarz L, Ding Z, El-Tayeb A, Huels S, Bönner F, Borg N, Jacoby C, Müller CE, van den Berg WB, Schrader J. |
| Selective activation of adenosine A2A receptors on immune cells by a CD73-dependent prodrug suppresses joint inflammation in experimental rheumatoid arthritis. |
| Sci Transl Med. 2012; 4: 146ra108. |
| Flögel U, Su S, Kreideweiß I, Ding Z, Galbarz L, Fu J, Jacoby C, Witzke O, Schrader J. |
| Noninvasive detection of graft rejection by in vivo 19F MRI in the early stage. |
| Am J Transplant. 2011; 11: 235-44. |
| |
| Ebner B, Behm P, Jacoby C, Burghoff S, French BA, Schrader J, Flögel U. |
| Early assessment of pulmonary inflammation by 19F MRI in vivo. |
| Circ Cardiovasc Imaging. 2010; 3: 202-10. |
|
|||